
Des nanoparticules d’or pour détruire les tumeurs
L’or, matériau aux propriétés exceptionnelles, est utilisé pour créer des bijoux mais aussi – on le sait moins – pour combattre le cancer. Plusieurs essais cliniques se déroulent actuellement aux Etats-Unis chez des patients traités à l’aide de nanoparticules d’or. ![]()
Sous sa forme naturelle, l’or est un métal jaune, inerte chimiquement et inoxydable, ce qui fait de lui un matériau noble qui ne se dégrade pas au cours du temps. Ces propriétés, alliées à sa facilité à être façonné, en font le matériau de choix des joailliers.
L’or possède d’autres propriétés remarquables à l’échelle nanométrique, c’est à dire du milliardième de mètre. À cette échelle, les particules d’or prennent des couleurs variables, en fonction de leur forme et de leur taille. Cette propriété est utilisée depuis l’antiquité pour colorer les verres et les faïences en leur donnant par exemple une couleur rubis intense. Lorsque les nanoparticules d’or sont éclairées par une source lumineuse, les électrons de conduction du métal sont excités par l’onde lumineuse et se mettent à osciller. Cette oscillation est particulièrement intense pour une couleur particulière du spectre lumineux. On parle alors de résonance.
En changeant la forme ou la taille des nanoparticules, il est possible de choisir la fréquence de résonance pour laquelle l’interaction avec la lumière est maximale. Les nanoparticules se comportent alors comme de minuscules antennes très efficaces et, bien qu’extrêmement petites et diluées, elles sont pourtant à l’origine des couleurs vives de nombreux vitraux.
Une conséquence de cette interaction intense avec la lumière incidente est de provoquer un échauffement des nanoparticules. C’est cette propriété remarquable qui est à l’origine de l’utilisation des nanoparticules dans de nouvelles thérapies contre le cancer. Le principe est de détruire les tumeurs par photothermie, c’est-à-dire de chauffer localement les tumeurs « décorées » de nanoparticules d’or en les éclairant.
Dans ce mode de traitement, la première étape consiste à injecter les nanoparticules d’or dans le flux sanguin du patient par une injection intraveineuse. L’or étant biocompatible, il ne présente a priori pas de danger pour la santé aux concentrations utilisées en thérapie, comme montré lors de nos travaux réalisés chez la souris. S’agissant d’applications en cours d’évaluation, les interrogations ne sont cependant pas encore toutes levées. Les nanoparticules d’or passent inaperçues pour le système de défense immunitaire. Leur taille nanométrique est typiquement cent fois plus petite que les cellules, ce qui leur permet de circuler librement dans le système sanguin et de pénétrer dans la tumeur.
Les nanoparticules doivent ensuite être concentrées au niveau des tumeurs. De nombreuses tumeurs sont très vascularisées – elles ont cette faculté de se doter d’un réseau de vaisseaux sanguins qui leur permet de croître. Profitant de cette voie d’accès, les nanoparticules s’accumulent naturellement à l’intérieur. Cet accroissement de la rétention au niveau des tumeurs est favorisé par une plus grande perméabilité des vaisseaux dont la structure est altérée au niveau des tumeurs.
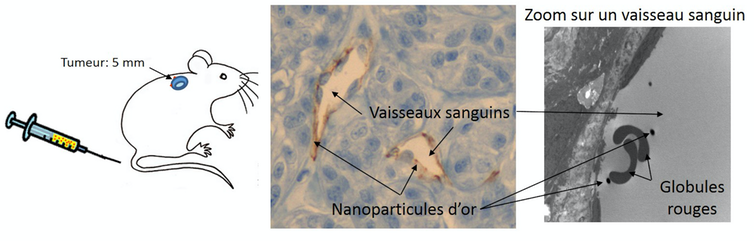
Les tumeurs ainsi « décorées » de nanoparticules d’or sont alors éclairées pour être chauffées et détruites. À cette étape, il faut relever un double défi. La lumière doit pénétrer dans les tissus jusqu’à la tumeur, mais les tissus sains, eux, ne doivent pas chauffer. Le choix de sa fréquence est donc essentiel. Il est en effet nécessaire d’éclairer les nanoparticules à leur fréquence de résonance mais il est tout aussi nécessaire que les tissus sans nanoparticule n’absorbent pas cette lumière.

Si dans le domaine visible du spectre lumineux (correspondant à l’ensemble des couleurs de l’arc en ciel), notre corps absorbe la lumière, il n’en est pas de même dans le proche infrarouge. Nous pouvons le constater simplement en plaçant notre main sur une lumière blanche intense. Seul le rouge, à la limite de l’infrarouge, parvient à traverser les tissus de la main.
Cette gamme du spectre dans le proche infrarouge est souvent désignée par le terme de « fenêtre thérapeutique », celle qui peut être utilisée dans un but de traitement médical. Dans le visible, c’est essentiellement l’hémoglobine qui absorbe cette lumière ; alors que plus loin dans l’infrarouge, c’est l’eau contenue dans notre corps.
Des nanoparticules aux formes particulières
En jouant sur la forme des nanoparticules, il est possible d’ajuster leur résonance pour cibler la fenêtre thérapeutique du proche infrarouge. Ceci est réalisé par exemple pour des nanoparticules formées d’un cœur de silice et d’une coquille d’or, pour des nano-bâtonnets d’or ou des nano-cages prenant la forme de cubes poreux. Des études pré-cliniques (chez l’animal) ont permis de tester l’efficacité et la sécurité des nanoparticules d’or sous de nombreuses formes.
Dans la fenêtre thérapeutique du spectre, la lumière traverse notre corps mais celui-ci n’est pas totalement transparent. La lumière, qui finit par ressortir, est néanmoins fortement diffusée par les tissus. Il est par exemple impossible de voir les os de cette façon, alors qu’on le fait lors d’une radiographie. Il est également très difficile de focaliser un faisceau lumineux sur une tumeur depuis l’extérieur du corps, car celui-ci traverse des tissus avant de l’atteindre.
Aussi, il est courant (dans les expériences menées sur des animaux) d’éclairer les tumeurs au plus près, en introduisant à travers la peau une aiguille munie d’une fibre optique reliée à un laser infrarouge. L’intensité lumineuse est alors beaucoup plus grande localement.
Des essais en cours dans les cancers de la tête et du cou
Sous l’action de la lumière, les nanoparticules d’or chauffent et « cuisent » la tumeur, détruisant les cellules cancéreuses à proximité. Des études probantes ont été menées sur des modèles animaux, par exemple pour les cancers du cerveau, de la prostate et du pancréas. Des essais cliniques sont en cours aux Etats-Unis chez des patients touchés par des cancers de la tête et du cou réfractaires aux traitements classiques, du poumon et de la prostate, avec la thérapie AuroLase (Nanospectra Bioscience).
Alternativement, les nanoparticules peuvent être utilisées non en tant qu’arme directe contre la tumeur mais en tant que transporteur (on parle d’un vecteur) pour y libérer des molécules une fois arrivées à destination, par exemple des médicaments. Cela nécessite un chauffage moins important. Cette vectorisation doit permettre de diminuer la toxicité des traitements en ciblant précisément les cellules cancéreuses.
La stratégie du cheval de Troie
Il est possible d’augmenter la pénétration des nanoparticules d’or dans les tumeurs, au-delà du simple effet d’accumulation passive. On les rend plus fonctionnelles en les recouvrant de molécules (anticorps) qui vont spécifiquement se fixer sur les cellules cancéreuses, dont elles reconnaissent des protéines présentes sur leur membrane. D’autres techniques alternatives adoptent la stratégie du « cheval de Troie ». Elles consistent à utiliser une sorte de globules blancs, les macrophages, que l’on remplit de nanoparticules d’or afin de pénétrer plus profondément dans les tumeurs.
La photothermie à partir de nanoparticules d’or représente une nouvelle thérapie prometteuse pour le traitement du cancer. Elle a commencé à être utilisée à titre expérimental chez des patients pour certains cancers spécifiques. De nombreuses recherches sont encore nécessaires avant de la proposer plus largement. Dans le futur, la technique devra cibler plus efficacement la tumeur et elle seule. Poussée par une recherche en pleine effervescence, cette thérapie devrait être disponible, en complément des thérapies existantes comme la radiothérapie ou la chimiothérapie, d’ici quelques années.
Découvrez les travaux d’Emmanuel Fort et de sa chaire AXA-ESPCI en imagerie biomédicale dans le cadre de l’Axa Research Fund.
Emmanuel Fort, Professeur à l’institut Langevin, spécialiste de l’interaction onde-matière, ESPCI Paris
La version originale de cet article a été publiée sur The Conversation.